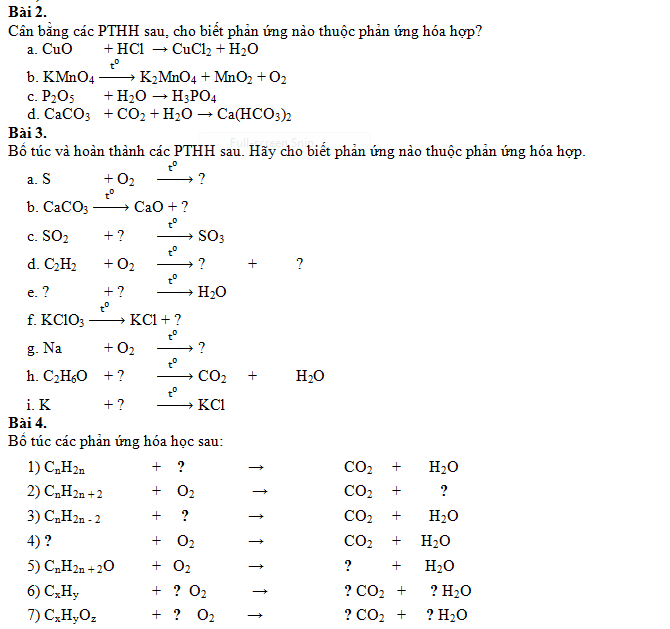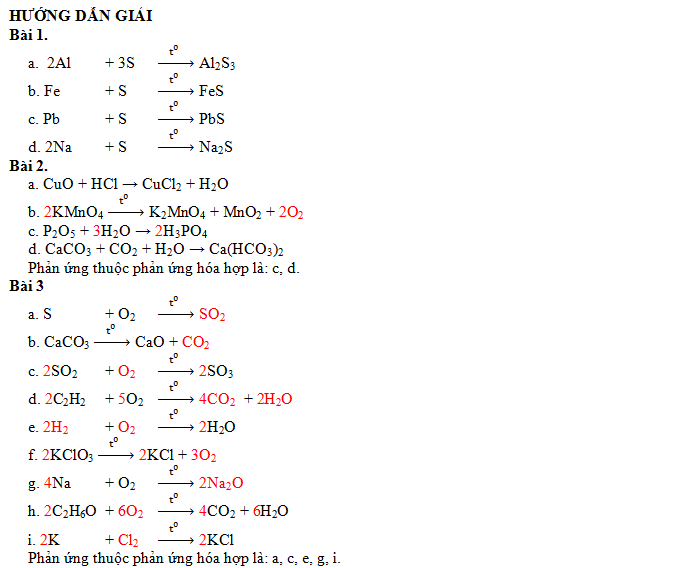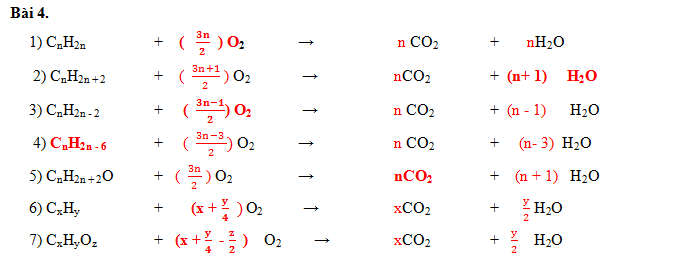Sự oxi hóa – Dạng 1 – viết PTHH và phân loại phản ứng
Bài viết giúp rèn luyện kĩ năng viết PTHH và cân bằng hóa học cũng, củng cố đầy đủ lý thuyết và sự oxi hóa, phản ứng hóa hợp cũng như tính chất của oxi!
Mời các bạn học sinh tham khảo thêm:
Điều chế oxi – phản ứng phân hủy
PP GIẢI BÀI TẬP BÀI 25: SỰ OXI HÓA – PHẢN ỨNG HÓA HỢP – ỨNG DỤNG CỦA OXI
Dạng 1: Viết PTHH, phân loại phản ứng hóa hợp

Sự oxi hóa – Dạng 1 – viết PTHH và phân loại phản ứng
III. BÀI TẬP VẬN DỤNG
Bài 1.
Hãy viết PTHH biểu diễn phản ứng hóa hợp của lưu huỳnh với các kim loại sau. (Biết trong hợp chất S có hóa trị II).
a) Nhôm
b) Sắt
c) Chì
d) Natri.
Tìm hiểu thêm:
Điều chế oxi – phản ứng phân hủy
Bài viết giúp bạn đọc biết và hiểu được phương pháp điều chế ô xi, cách thu khí O2 trong phòng thí nghiệm và cách sản xuất ô xi trong công nghiệp, đồng thời hiểu và phân biệt được đâu là phản ứng phân huỷ và dẫn ra được ví dụ minh hoạ.
ĐIỀU CHẾ OXI-PHẢN ỨNG PHÂN HỦY
I. Điều chế khí oxi trong phòng thí nghiệm:
2KMnO4 K2MnO4 + MnO2 + O2.
2KClO3 2KCl + 3O2.
* Cách thu khí oxi:
+ Bằng cách đẩy không khí.
+ Bằng cách đẩy nước.
=> Trong PTN, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân huỷ ở nhiệt độ cao như KMnO4 và KClO3.
II. Sản xuất khí o xi trong công nghiệp:
* Nguyên liệu: Không khí và nước.
a. Sản xuất khí oxi từ không khí.
b. Sản xuất khí oxi từ nước.
2H2O 2H2 + O2
III. Phản ứng phân huỷ:
VD:
2KMnO4 K2MnO4 + MnO2 + O2.
2KClO3 2KCl + 3O2.
2H2O 2H2 + O2
* Định nghĩa: Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới.
a. 2FeCl2 + Cl2 2FeCl3 (PƯHH)
b. CuO + H2 Cu + H2O.
c. 2KNO3 2KNO2 + O2(PƯPH)
d. 2Fe(OH)3 Fe2O3 + 3H2O(PƯPH)
e. CH4 + 2O2 CO2 + 2H2O.
Bài tập vận dụng
Bài 1: Cho các chất sau: FeO (1), KClO3 (2), KMnO4 (3), CaCO3 (4), không khí (5), H2O (6). Những chất nào được dùng để điều chế oxi trong phòng thí nghiệm?
A.1,2,3,5 B.2,3,5,6 C.2,3 D.2,3,5
Bài 2: Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất:
Khí oxi tan trong nước B.Khí oxi ít tan trong nước
C.Khí oxi khó hóa lỏng D.Khí oxi nhẹ hơn nước
Bài 3: Người ta thu khí oxi bằng cách đẩy không khí nhờ dựa vào tính chất:
A.Khí oxi nhẹ hơn không khí B.Khí oxi nặng hơn không khí
C.Khí oxi dễ trộn lẫn với không khí D.khí oxi ít tan trong nước
Bài 4: Cân bằng phương trình phản ứng và cho biết trong các phản ứng này phản ứng nào là phản ứng hoá hợp? Phản ứng nào là phản ứng phân huỷ?
a. H2 + O2 H2O
b. CuO + H2 Cu + H2O
c. KNO3 KNO2 + O2
d. Fe(OH)3 Fe2O3 + H2O
Bài 5: Trong phòng thí nghiệm cần điều chế 4,48l O2 (đktc). Dùng chất nào sau đây để có khối lượng nhỏ nhất:
A.KClO3 B.KMnO4 C.KNO3 D.H2O (điện phân)
Bài 6:Nguyên liệu để sản xuất O2 trong công nghiệp là phương án nào sau đây:
A. KMnO4 B. KClO3 C.KNO3 D. Không khí
Bài 7: Chọn định nghĩa phản ứng phân hủy đầy đủ nhất:
A.Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra một chất mới
B.Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai chất mới
C. Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới
D. Phản ứng phân hủy là phản ứng hóa học có chất khí thoát ra
Đáp án
Bài 1 C
Bài 2 A
Bài 3 B
Bài 4
a. 2H2 + O2 2H2O
b. CuO + H2 Cu + H2O
c. 2KNO3 2KNO2 + O2
d. 2Fe(OH)3 Fe2O3 + 3H2O
Phản ứng hoá hợp: a
Phản ứng phân huỷ: c, d
Bài 5 D
Bài 6 D
Bài 7 A