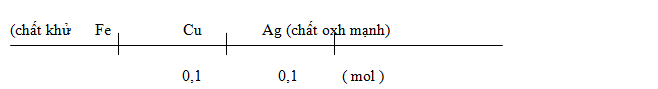PP dùng mốc so sánh trong toán về kim loại
Một phương pháp khá hay và linh hoạt. Giúp học sinh giải quyết các bài toán khó về kim loại
PHƯƠNG PHÁP DÙNG MỐC SO SÁNH TRONG GIẢI TOÁN VỀ KIM LOẠI TÁC DỤNG VỚI DUNG DỊCH MUỐI (NÂNG CAO)
I. LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
BÀI TOÁN 1: Nhúng 2 kim loại vào cùng 1 dung dịch muối của kim loại hoạt động hoá học yếu hơn (các kim loại tham gia phản ứng phải từ Mg trở đi).
Trường hợp 1: Nếu cho 2 kim loại trên vào 2 ống nghiệm đựng cùng 1 dung dịch muối thì lúc này cả 2 kim loại đồng thời cùng xảy ra phản ứng.
Ví dụ: Cho 2 kim loại là Mg và Fe vào 2 ống nghiệm chứa dung dịch CuSO4
Xảy ra đồng thời các phản ứng:
Mg + CuSO4 MgSO4 + Cu
Fe + CuSO4 FeSO4 + Cu
Trường hợp 2:
– Nếu cho hỗn hợp gồm 2 kim loại là: Mg và Fe vào cùng một ống nghiệm thì lúc này xảy ra phản ứng theo thứ tự lần lượt như sau:
Mg + CuSO4 MgSO4 + Cu ( 1 )
– Phản ứng (1) sẽ dừng lại khi CuSO4 tham gia phản ứng hết và Mg dùng với lượng vừa đủ hoặc còn dư. Lúc này dung dịch thu được là MgSO4; chất rắn thu được là Fe chưa tham gia phản ứng Cu vừa được sinh ra, có thể có Mg cò dư.
– Có phản ứng (2) xảy ra khi CuSO4 sau khi tham gia phản ứng (1) còn dư (tức là Mg đã hết)
Fe + CuSO4 FeSO4 + Cu ( 2 )
– Sau phản ứng (2) có thể xảy ra các trường hợp đó là:
+ Cả Fe và CuSO4 đều hết: dung dịch thu được sau 2 phản ứng là: MgSO4, FeSO4; chất rắn thu được là Cu.
+ Fe còn dư và CuSO4 hết: dung dịch thu được sau 2 phản ứng là: MgSO4, FeSO4; chất rắn thu được là Cu và có thể có Fe dư.
+ CuSO4 còn dư và Fe hết: dung dịch thu được sau 2 phản ứng là : MgSO4 , FeSO4 và có thể có CuSO4 còn dư ; chất rắn thu được là Cu.

PP dùng mốc so sánh trong toán về kim loại
Giải thích: Khi cho 2 kim loại trên vào cùng 1 ống nghiệm chứa muối của kim loại hoạt động hoá học yếu hơn thì kim loại nào hoạt động hoá học mạnh hơn sẽ tham gia phản ứng trước với muối theo quy ước sau:
Kim loại mạnh + Muối của kim loại yếu hơn Muối của kim loại mạnh hơn + Kim loại yếu
Trường hợp ngoại lệ:
Fe ( r ) + 2FeCl3( dd ) 3FeCl2 ( dd )
Cu ( r ) + 2FeCl3( dd ) 2FeCl2 ( dd ) + CuCl2 ( dd )
BÀI TOÁN 2: Cho hỗn hợp (hoặc hợp kim) gồm Mg và Fe vào hỗn hợp dung dịch muối của 2 kim loại yếu hơn. (các kim loại tham gia phản ứng phải từ Mg trở đi)
Bài tập mẫu: Cho hợp kim gồm Fe và Mg vào hỗn hợp dung dịch gồm AgNO3 và Cu(NO3)2 thu được dung dịch A và chất rắn B.
a/ Có thể xảy ra những phản ứng nào?
b/ Dung dịch A có thể có những muối nào và chất rắn B có những kim loại nào? Hãy biện luận và viết các phản ứng xảy ra.
Hướng dẫn
a. Do Mg hoạt động hoá học mạnh hơn Fe nên Mg sẽ tham gia phản ứng trước.
Vì Ion Ag + có tính oxi hoá mạnh hơn ion Cu 2+ nên muối AgNO3 sẽ tham gia phản ứng trước.
Tuân theo quy luật:
Chất khử mạnh + chất Oxi hoá mạnh Chất Oxi hoá yếu + chất khử yếu.
Nên có các phản ứng.
Mg + 2AgNO3 Mg(NO3)2 + 2Ag (1)
Mg + Cu(NO3)2 Cu(NO3)2 + Cu (2)
Fe + 2AgNO3 Fe(NO3)2 + 2Ag (3)
Fe + Cu(NO3)2 Fe(NO3)2 + Cu (4)
b. Có các trường hợp có thể xảy ra như sau.
Trường hợp 1: Kim loại dư, muối hết
* Điều kiện chung
– Dung dịch A không có: AgNO3 và Cu(NO3)2
– Chất rắn B có Ag và Cu.
– Nếu Mg dư thì Fe chưa tham gia phản ứng nên dung dịch A chỉ có Mg(NO3)2 và chất rắn B chứa Mg dư, Fe, Ag, Cu.
– Nếu Mg phản ứng vừa hết với hỗn hợp dung dịch trên và Fe chưa phản ứng thì dung dịch A chỉ có Mg(NO3)2 và chất rắn B chứa Fe, Ag, Cu.
– Mg hết, Fe phản ứng một phần vẫn còn dư (tức là hỗn hợp dung dịch hết) thì dung dịch A chứa Mg(NO3)2, Fe(NO3)2 và chất rắn B chứa Fe dư, Ag, Cu.
Trường hợp 2: Kim loại và muối phản ứng vừa hết.
Dung dịch A: Mg(NO3)2, Fe(NO3)2
Chất rắn B: Ag, Cu.
Trường hợp 3: Muối dư, 2 kim loại phản ứng hết.
* Điều kiện chung
– Dung dịch A chắc chắn có: Mg(NO3)2, Fe(NO3)2
– Kết tủa B không có: Mg, Fe.
– Nếu AgNO3 dư và Cu(NO3)2 chưa phản ứng: thì dung dịch A chứa AgNO3, Cu(NO3)2, Mg(NO3)2, Fe(NO3)2 và chất rắn B chỉ có Ag.(duy nhất)
– Nếu AgNO3 phản ứng vừa hết và Cu(NO3)2 chưa phản ứng: thì dung dịch A chứa Cu(NO3)2, Mg(NO3)2, Fe(NO3)2 và chất rắn B chỉ có Ag.(duy nhất)
– AgNO3 hết và Cu(NO3)2 phản ứng một phần vẫn còn dư: thì dung dịch A chứa Cu(NO3)2 dư Mg(NO3)2, Fe(NO3)2 và chất rắn B chỉ có Ag, Cu.
Bài tập mẫu: Một thanh kim loại M hoá trị II được nhúng vào trong 1 lit dung dịch CuSO4 0,5M. Sau một thời gian lấy thanh M ra và cân lại, thấy khối lượng của thanh tăng 1,6g, nồng độ CuSO4 giảm còn bằng 0,3M.
a/ Xác định kim loại M
b/ Lấy thanh M có khối lượng ban đầu bằng 8,4g nhúng vào hh dung dịch chứa AgNO3 0,2M và CuSO4 0,1M. Thanh M có tan hết không? Tính khối lượng chất rắn A thu được sau phản ứng và nồng độ mol/lit các chất có trong dung dịch B (giả sử thể tích dung dịch không thay đổi)
II. BÀI TẬP ÁP DỤNG
Bài 1: Nhúng một thanh kim loại M hoá trị II vào 0,5 lit dd CuSO4 0,2M. Sau một thời gian phản ứng, khối lượng thanh M tăng lên 0,40 g trong khi nồng độ CuSO4 còn lại là 0,1M.
a/ Xác định kim loại M.
b/ Lấy m(g) kim loại M cho vào 1 lit dd chứa AgNO3 và Cu(NO3)2 , nồng độ mỗi muối là 0,1M. Sau phản ứng ta thu được chất rắn A khối lượng 15,28g và dd B. Tính m(g)?
Bài 2: Cho 8,3 g hỗn hợp gồm Al và Fe có số mol bằng nhau vào 100ml hỗn hợp dung dịch chứa AgNO3 2M và Cu(NO3)2 1,5M. Xác định kim loại được giải phóng, khối lượng là bao nhiêu?
Bài 3: Một thanh kim loại M hoá trị II nhúng vào 1 lít dd FeSO4, thấy khối lượng M tăng lên 16g. Nếu nhúng cùng thanh kim loại ấy vào 1 lit dd CuSO4 thì thấy khối lượng thanh kim loại đó tăng lên 20g. Biết rằng các phản ứng nói trên đều xảy ra hoàn toàn và sau phản ứng còn dư kim loại M, 2 dd FeSO4 và CuSO4 có cùng nồng độ mol ban đầu.
a/ Tính nồng độ mol/lit của mỗi dd và xác định kim loại M.
b/ Nếu khối lượng ban đầu của thanh kim loại M là 24g, chứng tỏ rằng sau phản ứng với mỗi dd trên còn dư M. Tính khối lượng kim loại sau 2 phản ứng trên.
III. ĐÁP SỐ VỚI LỜI GIẢI
Bài 1.
Hướng dẫn giải:
a/ theo bài ra ta có PTHH .
Fe + CuSO4 FeSO4 + Cu (1)
Số mol Cu(NO3)2 tham gia phản ứng (1) là: 0,5 (0,2 – 0,1) = 0,05 mol
Độ tăng khối lượng của M là:
mtăng = mkl gp – mkl tan = 0,05 (64 – M) = 0,40
giải ra: M = 56, vậy M là Fe
b/ ta chỉ biết số mol của AgNO3 và số mol của Cu(NO3)2. Nhưng không biết số mol của Fe