Dạng toán hỗn hợp kim loại tác dụng với dung dịch muối
Kim loại tác dụng với dung dịch muối là một dạng toán với tần số xuất hiện trong các đề thi là khá cao.
Dạng toán này đòi hỏi hs cần nắm chắc kiến thức về tính chất của kim loại, đồng thời các kĩ năng tính toán hóa học nhanh nhạy
Mời các bạn học sinh tham khảo thêm:
Bài tập cơ bản về xác định công thức oxit sắt
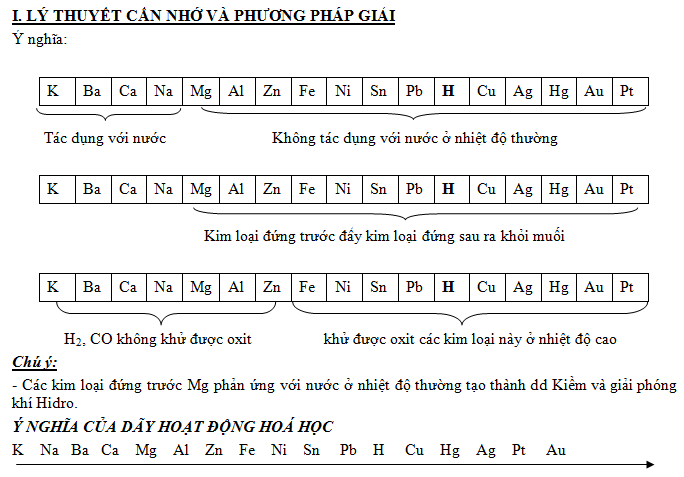
– Dãy được sắp xếp theo chiều giảm dần tính hoạt động hoá học (từ trái sang phải)
– Một số kim loại vừa tác dụng được với axit và với nước: K, Na, Ba, Ca
– Kim loại + H2O —-> Dung dịch bazơ + H2
– Kim loại vừa tác dụng với axit, vừa tác dụng với bazơ: (Be), Al, Zn, Cr
2A + 2(4 – n)NaOH + 2(n – 2)H2O —> 2Na4 – nAO2 + nH2
Ví dụ:
2Al + 2NaOH + 2H2O —-> 2NaAlO2+ 3H2
2Al + Ba(OH)2 + 2H2O —-> Ba(AlO2)2 + 3H2
Zn + 2NaOH —> Na2ZnO2 + H2
Zn + Ba(OH)2 —> BaZnO2 + H2
– Kim loại đứng trước H tác dụng với dung dịch axit HCl, H2SO4 loãng tạo muối và giải phóng H2.
Kim loại + Axit —-> Muối + H2
Lưu ý: Kim loại trong muối có hoá trị thấp (đối với kim loại đa hoá trị)
– Kể từ Mg trở đi kim loại đứng trước đẩy được kim loại đứng sau ra khỏi muối của chúng. theo quy tắc:
Chất khử mạnh + chất oxi hóa mạnh chất oxi hoá yếu + chất khử yếu.
Lưu ý: những kim loại đầu dãy (kim loại tác dụng được với nước) thì không tuân theo quy tắc trên mà nó xảy ra theo các bước sau:
Kim loại kiềm (hoặc kiềm thổ) + H2O Dung dịch bazơ + H2
Sau đó:
Dung dịch bazơ + dung dịch muối Muối mới + Bazơ mới (*)
Điều kiện(*): Chất tạo thành phải có ít nhất 1 chất kết tủa (không tan).
VD: cho Ba vào dung dịch CuSO4.
Trước tiên: Ba + 2H2O Ba(OH)2 + H2

Dạng toán hỗn hợp kim loại tác dụng với dung dịch muối
Sau đó:
Ba(OH)2 + CuSO4 Cu(OH)2 + BaSO4
Đặc biệt: Cu + 2FeCl3 —> CuCl2 + 2FeCl2
Cu + Fe2(SO4)3 —> CuSO4 + 2FeSO4
II. BÀI TẬP ÁP DỤNG
Bài 1. Có 200ml hỗn hợp dung dịch gồm AgNO3 0,1M và Cu(NO3)2 0,5M. Thêm 2,24g bột Fe kim loại vào dung dịch đó khuấy đều tới phản ứng hoàn toàn thu được chất rắn A và dung dịch B.
a/ Tính số gam chất rắn A.
b/Tính nồng độ mol/lit của các muối trong dung dịch B, biết rằng thể tích dung dịch không đổi.
Bài 2. Cho 1,68 g Fe vào 200ml hỗn hợp dung dịch gồm Cu(NO3)2 0,15M và AgNO3 0,1M. Sau khi phản ứng kết thúc thu được chất rắn A và dung dịch B.
a/ Tính khối lượng chất rắn A.
b/ Tính nồng độ mol/lit của dung dịch B. Giả sử thể tích dung dịch không thay đổi.
Bài 3. Nhúng 2 miếng kim loại Zn và Fe cùng vào một ống nghiệm đựng dung dịch CuSO4, sau một thời gian lấy 2 miếng kim loại ra thì trong dung dịch nhận được biết nồng độ của muối Zn gấp 2,5 lần muối Fe. Đồng thời khối lượng dung dịch sau phản ứng giảm so với trước phản ứng 0,11g. Giả thiết Cu giải phóng đều bám hết vào các thanh kim loại. Hãy tính khối lượng Cu bám trên mỗi thanh.
III. ĐÁP ÁN VÀ LỜI GIẢI
Bài 1.
Hướng dẫn giải
Fe + 2AgNO3 Fe(NO3)2 + 2Ag ( 1 )
Fe + Cu(NO3)2 Fe(NO3)2 + Cu ( 2 )
Số mol của các chất là: nFe = 0,04 mol ; nAgNO3 = 0,02 mol ; nCu(NO3)2 = 0,1 mol
Vì Ag hoạt động hoá học yếu hơn Cu nên muối của kim loại Ag sẽ tham gia phản ứng với Fe trước.
Theo pứ ( 1 ): nFe ( pứ ) = 0,01 mol ; Vậy sau phản ứng ( 1 ) thì nFe còn lại = 0,03 mol.
Theo (pứ ( 2 ): ta có nCu(NO3)2 pứ = nFe còn dư = 0,03 mol.
Vậy sau pứ ( 2 ): nCu(NO3)2 còn dư là = 0,1 – 0,03 = 0,07 mol
Chất rắn A gồm Ag và Cu
mA = 0,02 x 108 + 0,03 x 64 = 4,08g
dung dịch B gồm: 0,04 mol Fe(NO3)2 và 0,07 mol Cu(NO3)2 còn dư.
Thể tích dung dịch không thay đổi V = 0,2 lit
Vậy nồng độ mol/lit của dung dịch sau cùng là:
CM [ Cu(NO3 )2 ] dư = 0,35M ; CM [ Fe (NO3 ) 2] = 0,2M
Bài 2.
Đáp số:
a/ mA = 3,44g
b/ CM [ Cu(NO3 )2 ] dư = 0,05M và CM [ Fe (NO3 )2 ] = 0,15M
Bài 3
Chú ý: Cho hỗn hợp gồm bột sắt và kẽm vào trong cùng 1 ống nghiệm ( 1 lọ ) chứa dung dịch AgNO3.
Phản ứng xảy ra theo thứ tự như sau:
Kim loại có tính khử mạnh hơn sẽ tham gia phản ứng trước với muối.
Zn + 2AgNO3 Zn(NO3)2 + 2Ag
Fe + 2AgNO3 dư Fe(NO3)2 + 2Ag
Hướng dẫn giải:
– Nếu khối lượng thanh kim loại tăng = mkim loại giai phong – mkim loai tan
– Nếu khối lượng thanh kim loại tăng = mkim lo ại tan – mkim lo ai giai phong
Vì Zn hoạt động hoá học mạnh hơn Fe. Nên Zn tham gia phản ứng với muối trước.
Zn + CuSO4 ZnSO4 + Cu (1)
x x x x (mol)
Fe + CuSO4 FeSO4 + Cu (2)
y y y y (mol)
Vì khối lượng dung dịch giảm 0,11 g. Tức là khối lượng 2 thanh kim loại tăng 0,11 g
Theo định luật bảo toàn khối lượng ta có: (160y – 152y) + (160x – 161x) = 0,11
Hay 8y – x = 0,11 (I)
Mặt khác: nồng độ muối Zn = 2,5 lần nồng độ muối Fe
* Nếu là nồng độ mol/lit thì ta có x : y = 2,5 (II) (Vì thể tích dung dịch không đổi)
* Nếu là nồng độ % thì ta có 161x : 152y = 2,5 (II)/ (Khối lượng dd chung)
Giải hệ (I) và (II) ta được: x = 0,02 mol và y = 0,05 mol .
mCu = 3,2 g và mZn = 1,3 g
Giải hệ (I) và (II)/ ta được: x = 0,046 mol và y = 0,0195 mol
mCu = 2,944 g và mZn = 1,267 g