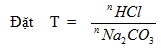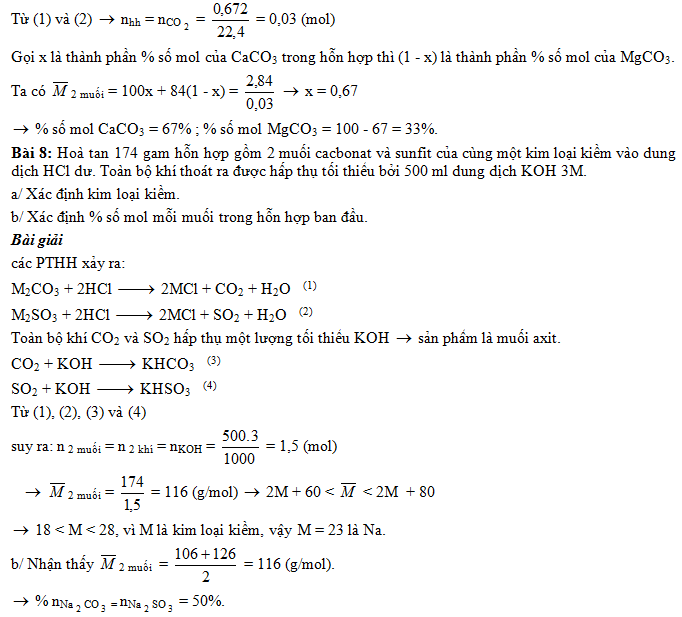Dạng toán axit tác dụng với muối
Mời các bạn học sinh tham khảo thêm:
Dạng toán bazơ tác dụng với dung dịch muối
Axit tác dụng với muối là một trong những tính chất hóa học quan trọng của axit.
Khi axit tác dụng với muối cần có những điều kiện phản ứng nào? Phương pháp giải toán đối với các dạng bài tập tính toán ra sao? Cùng tìm hiểu dạng toán axit tác dụng với dung dịch muối
I. LÝ THUYẾT CẦN NHỚ
1/ Phân loại axit
Gồm 3 loại axit tác dụng với muối.
a/ Axit loại 1:
Thường gặp là HCl, H2SO4loãng, HBr,..
Phản ứng xảy ra theo cơ chế trao đổi.
b/ Axit loại 2:
Là các axit có tính oxi hoá mạnh: HNO3, H2SO4đặc.
Phản ứng xảy ra theo cơ chế phản ứng oxi hoá khử.
c/ Axit loại 3:
Là các axit có tính khử.
Thường gặp là HCl, HI, H2S.
Phản ứng xảy ra theo cơ chế phản ứng oxi hoá khử.
2/ Công thức phản ứng.
a/ Công thức 1:
Muối + Axit —> Muối mới + Axit mới.
Điều kiện: Sản phẩm phải có:
– Kết tủa.
– Hoặc có chất bay hơi(khí).
– Hoặc chất điện li yếu hơn.
Đặc biệt: Các muối sunfua của kim loại kể từ Pb trở về sau không phản ứng với axit loại 1.
Ví dụ: Na2CO3 + 2HCl —> 2NaCl + H2O + CO2 (k)
BaCl2 + H2SO4 —> BaSO4(r) + 2HCl
b/ Công thức 2:
Muối + Axit loại 2 —> Muối + H2O + sản phẩm khử.
Điều kiện:
Muối phải có tính khử.
Muối sinh ra sau phản ứng thì nguyên tử kim loại trong muối phải có hoá trị cao nhất.
Chú ý: Có 2 nhóm muối đem phản ứng.
– Với các muối: CO32-, NO3–, SO42-, Cl– .
+ Điều kiện: Kim loại trong muối phải là kim loại đa hoá trị và hoá trị của kim loại trong muối trước phải ứng không cao nhất.
– Với các muối: SO32-, S2-, S2–.
+ Phản ứng luôn xảy ra theo công thức trên với tất cả các kim loại.
c/ Công thức 3:
Thường gặp với các muối sắt(III). Phản ứng xảy ra theo quy tắc 2.(là phản ứng oxi hoá khử)
2FeCl3 + H2S —> 2FeCl2 + S(r) + 2HCl.

Dạng toán axit tác dụng với muối
Chú ý:
Bài tập: Cho từ từ dung dịch HCl vào Na2CO3 (hoặc K2CO3) thì có các PTHH sau:
Giai đoạn 1 Chỉ có phản ứng.
Na2CO3 + HCl NaHCO3 + NaCl ( 1 )
x (mol) x mol x mol
Giai đoạn 2 Chỉ có phản ứng
NaHCO3 + HCl dư NaCl + H2O + CO2 ( 2 )
x x x mol
Hoặc chỉ có một phản ứng khi số mol HCl = 2 lần số mol Na2CO3.
Na2CO3 + 2HCl 2NaCl + H2O + CO2 ( 3 )
Đối với K2CO3 cũng tương tự.
Hướng giải: xét tỷ lệ số mol để viết PTHH xảy ra
Nếu T 1 thì chỉ có phản ứng (1) và có thể dư Na2CO3.
Nếu T 2 thì chỉ có phản ứng (3) và có thể dư HCl.
Nếu 1 < T < 2 thì có cả 2 phản ứng (1) và (2) ở trên hoặc có thể viết như sau.
Đặt x là số mol của Na2CO3 (hoặc HCl) tham gia phản ứng ( 1 )
Na2CO3 + HCl NaHCO3 + NaCl ( 1 )
x (mol) x mol x mol
Na2CO3 + 2HCl 2NaCl + H2O + CO2 ( 2 ) !
Tính số mol của Na2CO3 (hoặc HCl) tham gia phản ứng(2!)dựa vào bài ra và qua phản ứng(1).
Thí dụ: Cho từ từ dung dịch chứa x(mol) HCl vào y (mol) Na2CO3 (hoặc K2CO3). Hãy biện luận và cho biết các trường hợp có thể xảy ra viết PTHH , cho biết chất tạo thành, chất còn dư sau phản ứng:
TH 1: x < y
Có PTHH: Na2CO3 + HCl NaHCO3 + NaCl
x x x x mol
– Dung dịch sau phản ứng thu được là: số mol NaHCO3 = NaCl = x (mol)
– Chất còn dư là Na2CO3 (y – x) mol
TH 2: x = y
Có PTHH : Na2CO3 + HCl NaHCO3 + NaCl
x x x x mol
– Dung dịch sau phản ứng thu được là: NaHCO3 ; NaCl
– Cả 2 chất tham gia phản ứng đều hết.
TH 3: y < x < 2y
Có 2 PTHH: Na2CO3 + HCl NaHCO3 + NaCl
y y y y mol
sau phản ứng (1) dung dịch HCl còn dư (x – y) mol nên tiếp tục có phản ứng
NaHCO3 + HCl NaCl + H2O + CO2
(x – y) (x – y) (x – y) (x – y)
– Dung dịch thu được sau phản ứng là: có x(mol) NaCl và (2y – x)mol NaHCO3 còn dư
TH 4: x = 2y
Có PTHH: Na2CO3 + 2HCl 2NaCl + H2O + CO2
y 2y 2y y mol
– Dung dịch thu được sau phản ứng là: có 2y (mol) NaCl, cả 2 chất tham gia phản ứng đều hết.
TH 5: x > 2y
Có PTHH: Na2CO3 + 2HCl 2NaCl + H2O + CO2
y 2y 2y y mol
– Dung dịch thu được sau phản ứng là: có 2y (mol) NaCl và còn dư (x – 2y) mol HCl.
Bài tập 5: Cho từ từ dung dịch HCl vào hỗn hợp muối gồm NaHCO3 và Na2CO3 (hoặc KHCO3 và K2CO3) thì có các PTHH sau:
Đặt x, y lần lượt là số mol của Na2CO3 và NaHCO3.
Giai đoạn 1: Chỉ có Muối trung hoà tham gia phản ứng.
Na2CO3 + HCl NaHCO3 + NaCl ( 1 )
x (mol) x mol x mol
Giai đoạn 2: Chỉ có phản ứng
NaHCO3 + HCl dư NaCl + H2O + CO2 ( 2 )
(x + y) (x + y) (x + y) mol
Đối với K2CO3 và KHCO3 cũng tương tự.
Bài tập: Cho từ từ dung dịch HCl vào hỗn hợp muối gồm Na2CO3; K2CO3; NaHCO3 thì có các PTHH sau:
Đặt x, y, z lần lượt là số mol của Na2CO3; NaHCO3 và K2CO3.
Giai đoạn 1: Chỉ có Na2CO3 và K2CO3 phản ứng.
Na2CO3 + HCl NaHCO3 + NaCl ( 1 )
x (mol) x x x
K2CO3 + HCl KHCO3 + KCl ( 2 )
z (mol) z z z
Giai đoạn 2: có các phản ứng
NaHCO3 + HCl dư NaCl + H2O + CO2 ( 3 )
(x + y) (x + y) (x + y) mol
KHCO3 + HCl dư KCl + H2O + CO2 ( 4 )
z (mol) z z mol
Bài tập: Cho từ từ dung dịch HCl vào dung dịch NaAlO2 thì có các PTHH sau.
NaAlO2 + HCl + H2O Al(OH)3 + NaCl ( 1 )
Al(OH)3 + 3HCl dư AlCl3 + 3H2O ( 2 )
NaAlO2 + 4HCl AlCl3 + NaCl + 2H2O ( 3 )
II. BÀI TẬP ÁP DỤNG
Bài 1: Hoà tan Na2CO3 vào V(ml) hỗn hợp dung dịch axit HCl 0,5M và H2SO4 1,5M thì thu được một dung dịch A và 7,84 lit khí B (đktc). Cô cạn dung dịch A thu được 48,45g muối khan.
a/ Tính V(ml) hỗn hơp dung dịch axit đã dùng?
b/ Tính khối lượng Na2CO3 bị hoà tan.
Hướng dẫn:
Giả sử phải dùng V(lit) dung dịch gồm HCl 0,5M và H2SO4 1,5M.
Na2CO3 + 2HCl —> 2NaCl + H2O + CO2
0,25V 0,5V 0,5V 0,25V (mol)
Na2CO3 + H2SO4 —> Na2SO4 + H2O + CO2
1,5V 1,5V 1,5V 1,5V (mol)
Theo bài ra ta có:
Số mol CO2 = 0,25V + 1,5V = 7,84 : 22,4 = 0,35 (mol) (I)
Khối lượng muối thu được: 58,5.0,5V + 142.1,5V = 48,45 (g) (II)
V = 0,2 (l) = 200ml.
Số mol Na2CO3 = số mol CO2 = 0,35 mol
Vậy khối lượng Na2CO3 đã bị hoà tan:
mNa2CO3 = 0,35 . 106 = 37,1g.
Bài 2:
a/ Cho 13,8 gam (A) là muối cacbonat của kim loại kiềm vào 110ml dung dịch HCl 2M. Sau phản ứng thấy còn axit trong dung dịch thu được và thể tích khí thoát ra V1 vượt quá 2016ml. Viết phương trình phản ứng, tìm (A) và tính V1 (đktc).
b/ Hoà tan 13,8g (A) ở trên vào nước. Vừa khuấy vừa thêm từng giọt dung dịch HCl 1M cho tới đủ 180ml dung dịch axit, thu được V2 lit khí. Viết phương trình phản ứng xảy ra và tính V2 (đktc).
Hướng dẫn:
a/ M2CO3 + 2HCl —> 2MCl + H2O + CO2
Theo PTHH ta có:
Số mol M2CO3 = số mol CO2 > 2,016 : 22,4 = 0,09 mol
—> Khối lượng mol M2CO3 < 13,8 : 0,09 = 153,33 (I)
Mặt khác: Số mol M2CO3 phản ứng = 1/2 số mol HCl < 1/2. 0,11.2 = 0,11 mol
—> Khối lượng mol M2CO3 = 13,8 : 0,11 = 125,45 (II)
Từ (I, II) –> 125,45 < M2CO3 < 153,33 —> 32,5 < M < 46,5 và M là kim loại kiềm
—> M là Kali (K)
Vậy số mol CO2 = số mol K2CO3 = 13,8 : 138 = 0,1 mol —> VCO = 2,24 (lit)
b/ Giải tương tự: —> V2 = 1,792 (lit)
Bài 3: Hoà tan CaCO3 vào 100ml hỗn hợp dung dịch gồm axit HCl và axit H2SO4 thì thu được dung dịch A và 5,6 lit khí B (đktc), cô cạn dung dịch A thì thu được 32,7g muối khan.
a/ Tính nồng độ mol/l mỗi axit trong hỗn hợp dung dịch ban đầu.
b/ Tính khối lượng CaCO3 đã dùng.
Bài 4: Cho 4,2g muối cacbonat của kim loại hoá trị II. Hoà tan vào dung dịch HCl dư, thì có khí thoát ra. Toàn bộ lượng khí được hấp thụ vào 100ml dung dịch Ba(OH)2 0,46M thu được 8,274g kết tủa. Tìm công thức của muối và kim loại hoá trị II.
Đáp số:
TH1 khi Ba(OH)2 dư, thì công thức của muối là: CaCO3 và kim loại hoá trị II là Ca.
TH2 khi Ba(OH)2 thiếu, thì công thức của muối là MgCO3 và kim loại hoá trị II là Mg.
Bài 5: Cho 1,16g muối cacbonat của kim loại R tác dụng hết với HNO3, thu được 0,448 lit hỗn hợp G gồm 2 khí có tỉ khối hơi so với hiđro bằng 22,5. Xác định công thức muối (biết thể tích các khí đo ở đktc).
Bài 6: Cho 5,25g muối cacbonat của kim loại M tác dụng hết với HNO3, thu được 0,336 lit khí NO và V lit CO2. Xác định công thức muối và tính V. (biết thể tích các khí được đo ở đktc)
Đáp số: Giải tương tự bài 3 —> CTHH là FeCO3
Bài 7: Hoà tan 2,84 gam hỗn hợp 2 muối CaCO3 và MgCO3 bằng dung dịch HCl dư thu được 0,672 lít khí CO2 (đktc). Tính thành phần % số mol mỗi muối trong hỗn hợp.
Bài giải
Các PTHH xảy ra:
CaCO3 + 2HCl CaCl2 + CO2 + H2O (1)
MgCO3 + 2HCl MgCl2 + CO2 + H2O (2)