Tính chất, ứng dụng của Hiđro
Hiđro có ứng dụng quan trọng trong đời sống hàng ngày. Vậy hiđro có những tính chất nào????
Bài tập nâng cao : Hiđro – Nước

Tính chất, ứng dụng của Hiđro
Bài tập được hệ thống một cách đầy đủ và toàn diện về chương hiđro – nước.
BÀI TẬP NÂNG CAO CHƯƠNG 5 : HIĐRO – NƯỚC
Bài 1. Các phương trình phản ứng hóa học nào sau đây là phản ứng oxi hóa khử:
a. CO + O2 → CO2
b. Al + Fe2O3 → Al2O3 + Fe
c. Mg + CO2 → MgO + CO
d. CO + H2O → CO2 +H2
e. CaO + H2O → Ca(OH)2
và cân bằng phản ứng oxi hóa khử, cho biết chất oxi hóa, chất khử
Bài 2. Phân biệt các loại chất có công thức hóa học sau:
HCl; CaO; Cu(OH)2; Fe; S; Na; P; P2O5; SO3; NaHCO3; KOH; KNO3; H2SO4.
Bài 3. Các chất nào sau đây điều chế hiđro
A. H2O; HCl ; H2SO4
B. HNO3; H3PO4; NaHCO3
C. CaCO3; Ca(HCO3)2; KClO3
D. NH4Cl; KMnO4; KNO3
Hãy chọn đáp án đúng.
Bài 4. Các chất nào sau đây có thể tác dụng được với nhau? Hãy viết phương trình phản ứng đó:
H2; Al2O3; FeO; SO2; P2O5; K; H2O
Bài 6. Một học sinh làm thí nghiệm như sau:
a. Nung nóng canxi cacbonat.
b. Cho một cây đinh sắt vào lọ chứa dung dịch đồng sunfat, sau một thời gian có vết màu đỏ bám vào cây đinh.
c. Dẫn khí hiđro đi qua chì (II) oxit nung nóng.
d. Đốt cháy một mẩu than
Các thí nghiệm trên thuộc loại phản ứng hóa học nào sau đây?
A. Phản ứng oxi hóa – khử
B. Phản ứng hóa hợp
C. Phản ứng phân hủy
D. Phản ứng thế
E. Tất cả các phản ứng trên
Bài 7. Dùng phương pháp hóa học để phân biệt các chất khí sau:
a. H2, NH3, O2 và khí CO2
b. SO2, CO và khí N2
Bài 8. Làm thế nào để tách được khí CO2 và O2 thành từng chất khí riêng biệt.
Bài 9. Các trường hợp nào sau đây chứa lượng hiđro nhiều nhất.
A. 6. 1023 phân tử H2
B. 5,6 lít CH4 (đktc)
C. 6. 1023 phân tử H2
D. 1,5 g NH4Cl
Chọn phương án đúng nhất.
Bài 10. Người ta điều chế được 24 g đồng bằng cách dùng hiđro để khử đồng (II) oxit.
a. Khối lượng đồng (II) oxit bị khử là:
A. 15 g B. 45 g C. 60 g D. kết quả khác.
b. Thể tích hiđro (đktc) đã dùng là:
A.8,4 lít B. 12,6 lít C. 4,2 lít D. kết quả khác
Chọn phương án đúng nhất.
Tính chất, ứng dụng của Hiđro
Bài 11. Cho 13 g kẽm tác dụng với 0,3 mol axit HCl thì thu được:
a. Khối lượng ZnCl2 là:
A. 20,4g B. 47g C. 40 g D. 18,5g
b. Thể tích hiđro (đktc) thu được là:
A. 3 lít B. 3,36 lít C. 4,48 lít D. 5,6 lít
Bài 12.
a. Cho 6 gam magie tác dụng với dung dịch H2SO4. Hãy cho biết thể tích khí hiđro sinh ra ở đktc ?
b. Nếu dùng thể tích H2 ở trên để khử 32 g sắt (III) oxit thì thu được bao nhiêu gam sắt?
Bài 13. Cho 7,5 gam hỗn hợp gồm Al và Mg tác dụng với dung dịch HCl.
a. Hãy tính khối lượng hỗn hợp muối khan thu được sau phản ứng. Biết nhôm chiếm 36% trong hỗn hợp ban đầu.
b. Tính thể tích hiđro (đktc) thu được ở trên?
Bài 14. Cho 35,4 g hỗn hợp kim loại gồm Fe, Zn tác dụng với dung dịch axit HCl thì thu được 13,44 lít H2 (đktc). Tính khối lượng mỗi kim loại.
Bài 15. Để khử hoàn toàn 68 g hỗn hợp oxit kim loại gồm CuO và Fe2O3 thì phải dùng 25,76 lít H2 (đktc). Tính thành phần % về khối lượng của mỗi oxit trong hỗn hợp.
LỜI GIẢI VÀ ĐÁP ÁN
Bài 1. Học sinh tự viết PTHH
Chất oxi hóa: O2; Fe2O3; CO2; H2O
Chất khử : CO; Al; Mg
Bài 2.
Phi kim: S; P
Kim loại: Fe, Na
Oxit axit: P2O5; SO3
Oxit bazơ: CaO
Bazơ: KOH; Cu(OH)2
Muối: NaHCO3; KNO3

Tính chất, ứng dụng của Hiđro
Bài 3.
Đáp án A
Bài 4. Học sinh tự viết phương trình
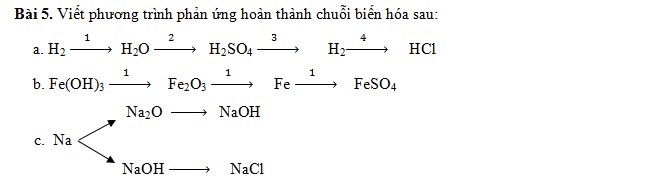
Bài 5. Học sinh tự viết phương trình hóa học
Bài 6.
Đáp án E
Bài 7.
a. Đáp án:
B1: Than hồng → O2 (than bùng cháy ); CO2 (than tắt)
B2: Quì ẩm → NH3 (xanh quì tím ẩm)
Còn lại: H2
b. Đáp án:
B1: dd brom → SO2 (mất màu dung dịch bromo)
B2: CuO → CO (oxit đồng từ đen chuyển sang màu đỏ)
Còn lại là khí N2
Bài 8.
Các bước thực hiện: Đưa dung dịch qua nước vôi trong dư → CO2 bị giữ lại, phản ứng tạo kết tủa còn O2 đi ra → Lọc kết tủa nung thu được CO2
Bài 9. Đáp án A
Bài 10
a. Đáp án D
b. Đáp án A
Bài 11.
a. Đáp án A
b. Đáp án B
Bài 12.
a. 5, 6 lít
b. 112 g
Bài 13.
a. 32,35
b. 7,84 lít
Bài 14.
mFe = 22,4 g; mZn = 13 g
Bài 15.
% CuO = 29,41%
% Fe2O3 = 70,59%