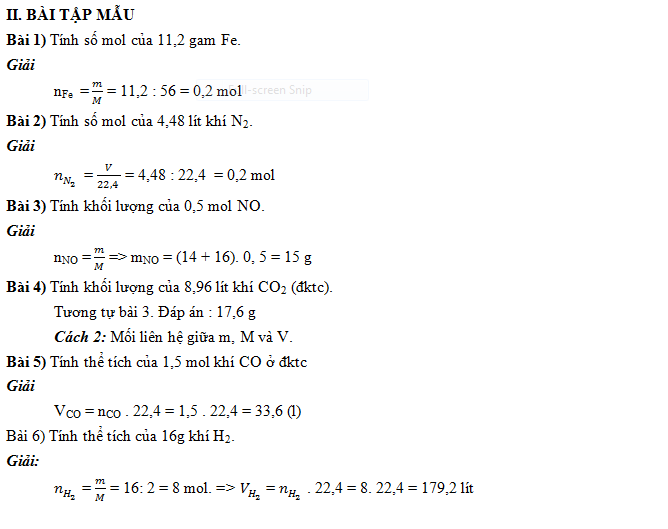Bài tập án dụng công thức n = V / 22,4 (có lời giải chi tiết)
Mời các bạn học sinh tham khảo thêm:
Bài tập tổng hợp vận dụng công thức n = m/ M; v = v/ 22,4 (có đáp án)
Bải giảng giúp một lần nữa củng cố kiến thức đã học từ đó tạo hứng thú học tập môn học yêu thích này.

Bài tập án dụng công thức n = V / 22,4 (có lời giải chi tiết)
Bài tập án dụng công thức n = V / 22,4 (có lời giải chi tiết)
Toàn bộ công thức tính toán liên quan tới đại lượng mol “n” đã được tổng hợp trong dạng bài dưới đây! Cùng bắt tay vào giải quyết bài tập nào!!!!
III. BÀI TẬP ÁP DỤNG
Bài 1
a) Trong 8,4 g sắt có bao nhiêu mol sắt?
b) Tính thể tích của 8 g khí oxi.
c) Tính khối lượng của 67,2 lít khí nitơ.
Bài 2
a) Trong 40 g natri hidroxit NaOH có bao nhiêu phân tử?
b) Tính khối lượng của 12.1023 nguyên tử nhôm.
c) Trong 28 g sắt có bao nhiêu nguyên tử sắt?
Bài 3
a) 2,5 mol H có bao nhiêu nguyên tử H?
b) 9.1023 nguyên tử canxi là bao nhiêu gam ganxi?
c) 0,3 mol nước chứa bao nhiêu phân tử nước?
d) 4,5.1023 phân tử H2O là bao nhiêu mol H2O?
Bài 4
Một hỗn hợp khí X gồm 0,25 mol khí SO2; 0,15 mol khí CO2; 0,65 mol khí N2và 0,45 mol khí H2.
a) Tính thể tích của hỗn hợp khí X (đktc).
b) Tính khối lượng của hỗn hợp khí X.
Bài 5
a) Hãy giải thích vì sao 1 mol các chất ở trạng thái rắn, lỏng, khí tuy có số phân tử như nhau nhưng lại có thể tích không bằng nhau?
b) Hãy giải thích vì sao trong cùng điều kiện nhiệt độ và áp suất, 1 mol khí hidro và 1 mol khí cacbonic có thể tích bằng nhau. Nếu ở đktc thì chúng có thể tích là bao nhiêu?
Bài 6
Trong 8 g lưu huỳnh có bao nhiêu mol, bao nhiêu nguyên tử S? Phải lấy bao nhiêu gam kim loại natri để có số nguyên tử natri nhiều gấp 2 lần số nguyên tử S?
Bài 7
Trong 24 g magie oxit có bao nhiêu mol, bao nhiêu phân tử MgO? Phải lấy bao nhiêu gam axit clohidric để có số phân tử HCl nhiều gấp 2 lần số phân tử MgO?
Bài 8
Tính số hạt vi mô (nguyên tử hoặc phân tử) của: 0,25 mol O2; 27 g H2O; 28 g N; 0,5 mol C; 50 g CaCO3; 5,85 g NaCl.
IV. HƯƠNG DẪN
Bài 1
a) nFe = 0,15 mol.
b) = 5,6 lít
c) = 84 gam
Bài 2
a) Số phân tử NaOH: 6. 10 23 phân tử
b) mAl = 2 . 27 = 54 (g)
c) c) nFe = 28 / 56 = 0,5 (mol)
Số nguyên tử Fe = 0,5 . N = 0,5 . 6.1023 = 3.1023 (nguyên tử)
Bài 3
ĐS
a) 15.1023 nguyên tử.
b) b) 60 g.
c) c) 1,8.1023 phân tử.
d) d) 0,75 mol.
Bài 5
a) Vì thể tích 1 mol chất phụ thuộc vào kích thước của phân tử và khoảng cách giữa các phân tử của chất, mà các chất khác nhau thì có phân tử với kích thước và khoảng cách giữa chúng khác nhau.
b) b) Trong chất khí, khoảng cách giữa các phân tử là rất lớn so với kích thước của phân tử. Do vậy thể tích của chất khí không phụ thuộc vào kích thước phân tử mà phụ thuộc vào khoảng cách giữa các phân tử. Trong cùng điều kiện nhiệt độ và áp suất, các chất khí khác nhau có khoảng cách giữa các phân tử xấp xỉ bằng nhau. Nếu ở đktc thì 1 mol của bất kỳ chất khí gì cũng có thể tích là 22,4 lít.
Bài 6
nS = 8 / 32 = 0,25 (mol)
Số nguyên tử S là: 0,25 . 6.1023 = 1,5.1023 (nguyên tử)
Số nguyên tử Na gấp 2 lần số nguyên tử S => nNa = 2nS = 0,5 mol.
mNa = 0,5 . 23 = 11,5 (g).
Bài 7
ĐS
a) nMgO = 0,6 mol
b) b) Số phân tử MgO: 3,6.1023 (phân tử)
c) c) mHCl = 1,2 . 36,5 = 43,8 g
Bài 8
ĐS:
1,5.1023 phân tử O2
9. 1023 phân tử H2O
6. 1023 phân tử N2
3. 1023 nguyên tử C
3. 1023 phân tử CaCO3
0,6.1023 phân tử NaCl